糖基化修饰对蛋白质的理化特性和功能有着重要影响。对于非抗体类重组蛋白来说,糖基化修饰作用主要是影响稳定性、半衰期及生物学效应。而对于抗体类重组蛋白,糖基化修饰主要影响其抗体依赖细胞毒性(ADCC)及补体依赖细胞毒性(CDC)。单克隆抗体药物的糖基化结构对于药物的疗效和安全具有重要意义,且具有高度的异质性。由于糖基化种类的多样性以及连接方式的多样性,因而形成了自然界中最复杂和最多样化的蛋白结构。
糖基化修饰是复杂的酶促系列反应,因此不同宿主细胞自身修饰酶的酶活水平差异直接影响了抗体的糖基化修饰水平。重组蛋白表达系统主要包括哺乳动物细胞、酵母细胞和大肠杆菌等。由于具有能够表达与人类相似的糖基化蛋白能力,哺乳动物细胞表达系统应用最广,包括人源的HEK293 和PER.C6、鼠源的CHO、NS0、SP2/0、BHK、MF-9 等细胞系,目前抗体药物商业化生产用宿主细胞主要是CHO、NS0、SP2/0 细胞,其中CHO 细胞应用最为广泛。
不同宿主细胞甚至不同克隆间的生长、代谢、重组蛋白表达能力和修饰水平均存在一定差异,所以,选择合适的宿主细胞,甚至选择合适的克隆十分关键。宿主细胞和克隆本身的糖基化修饰酶水平存在先天差异,主要区别在于唾液酸化、半乳糖化、高甘露糖、岩藻糖化等。因此对于生物类似药研究和生产,优先选择与原研药相同的宿主细胞,且在项目早期如克隆筛选过程中提前关注糖型结构的差异性。对于生物药新药研究,重点考虑宿主细胞或者克隆本身特点带来的质量影响,从而指导后续培养工艺和纯化工艺,控制质量走向。
目前绝大多数治疗类重组蛋白主要使用哺乳动物细胞作为宿主细胞进行表达和制备。尽管其他异源表达系统,如大肠杆菌(表达重组人胰岛素)、酵母细胞(表达重组人干扰素)、昆虫细胞(表达人乳头瘤病毒蛋白)作为过去几十年重要的宿主细胞,但是哺乳动物细胞因其具有能够表达与人类相似的糖基化蛋白的优势,而在现代生物制药中占据更加主要的地位。
据报道,人类的IgG末端唾液酸残基以α-2,6连接, CHO细胞来源的抗体以α-2,3连接。然而,无论是人类的IgG,还是CHO细胞来源的抗体,末端唾液酸残基的含量都很低(仅有不到5%的糖含有唾液酸残基)。因此,唾液酸残基连接的不同对产品的质量可能不会造成影响。而且,许多人类血清糖蛋白也含有α-2,3连接的唾液酸残基。
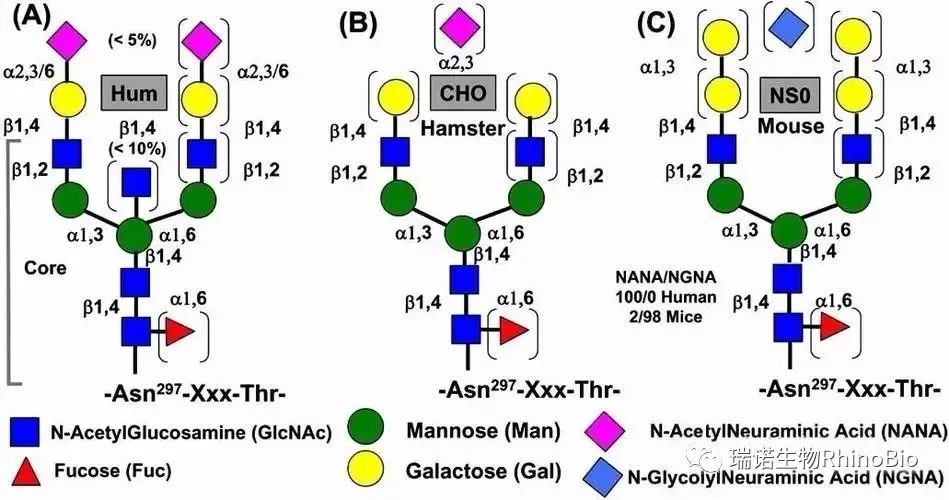
图1. 重组单抗聚糖结构. A. 人源细胞;B.CHO细胞系;C.鼠源细胞系(NA-0,SP2/0)
鼠源细胞系NS-0糖基化的机制表现出极大的不同之处(图1)。一些糖基化水平的改变对产品的质量和生物学活性会产生极大的影响。大多数鼠源细胞系含有一种额外的糖基化酶,这种α-1,3半乳糖苷酶主要介导半乳糖残基从α构象的UDP-Gal转移到末端半乳糖残基上。人体内含有抗α半乳糖表位的抗体。另外,鼠源细胞系产生NGNA,而并不是产生NANA。NGNA和NANA的区别是NGNA有一个额外的氧原子。并且,糖蛋白中若含有NGNA残基,被认为与人体的免疫原性密切相关。一些已上市的治疗型糖蛋白因为含有NGNA残基而在患者体内引起严重的不良反应。鼠源细胞系NS-0和CHO细胞系在岩藻糖基化、半乳糖基化、甘露糖基化水平上的表达区别尚未见研究报道。
蛋白质翻译后修饰是细胞内新生蛋白质成熟的重要步骤,是蛋白质结构及功能多样性和调节精细性的重要细胞生物化学基础。目前发现,与治疗性重组蛋白的结构及功能密切相关的蛋白质翻译后修饰为糖基化修饰。蛋白质的糖基化修饰是蛋白质翻译的同时或翻译后发生,在多种酶的作用下将糖基或糖链连接至多肽链上,经过不同程度的剪切和置换最终形成糖化蛋白的过程。
糖基化可增加蛋白质对热、变性剂及蛋白酶的抵抗力,进而维持蛋白质结构的完整性。另外,糖基化修饰还能提高重组蛋白的溶解性,如糖链唾液酸因其含有亲水的基团而在一定程度上屏蔽了疏水基团的疏水作用从而提高了重组蛋白的溶解性。
通过糖基化修饰增加重组蛋白药效学的目的是直接增加其在血液中的半衰期或循坏保留时间,即降低清除率。如提高促卵泡激素(FSH)唾液酸含量(高度唾液酸化亚型),可显著降低其肾脏清除率、提高其体内活性。
糖基化修饰可改变重组蛋白的免疫原性,如DA(Darbeprotein alfa)是一种新型的促红细胞生成素,是经N-糖基化修饰的rhEPO,避免了无糖基化修饰的rhEPO 诱导机体产生中和抗体的负效应。
另外研究表明,单抗药物的N-糖基化修饰对抗体的ADCC及CDC 活性均有一定的影响。IgG 抗体药物的糖基化修饰主要类型见表1。

由此可见,糖基化修饰对治疗性抗体疗效、安全性及药代动力学发挥着重大的作用,在现代单克隆抗体产业中,调整和控制糖基化修饰至关重要。
维多利亚老品牌vic3308生物提供多种糖苷酶和蛋白酶,用于重组蛋白生产及质控中糖基化修饰的表征。
1. 周小菊,纳涛等. 糖基化基因修饰对重组蛋白表达及活性的影响. 中国生物制品学杂志. 2018 年9 月第31 卷第9 期.
2. 江一帆,贾宇,王龙,王志明. 细胞培养过程对单克隆抗体糖基化修饰的影响和调控. 中国生物工程杂志. 2019,39( 8) : 95-103.
3. 王冲. 单克隆抗体糖基化修饰研究进展. 现代免疫学.2017年第37卷第3期.
4. 刘晓宇. 单克隆抗体糖基化修饰的研究现状及进展. 中国生物制品学杂志2020年2月第33卷第2期.